NOTICIAS
Resumen: 31st Meeting of the Working Group on Prolamin Analysis and Toxictiy (WGPAT)

La ciudad alemana de Minden acogió, entre el 28 y el 30 de septiembre, la reunión del Grupo de Trabajo sobre Análisis y Toxicidad de las Prolaminas para poner en común los últimos avances en la detección de gluten en alimentos y también en métodos analíticos para el diagnóstico de la enfermedad celíaca. Esta reunión albergó, además, un simposio dedicado a la microbiota intestinal y finalizó con un repaso del estado actual de los aspectos legales relativos a los métodos analíticos de gluten.

Sesión analítica
El Dr. Markus Brandt (Minden, Alemania), responsable de investigación, desarrollo y calidad de la empresa Ernst Böcker GmbH & Co., anfitriona de esta reunión, inició la sesión explicando la importancia de la fermentación de cereales en la alimentación, a lo que se dedica la compañía en la que trabaja desde su creación en 1910 y que actualmente está gestionada por la cuarta generación de la familia fundadora.
Según comentó, existen evidencias arqueológicas que acreditan que ya en el año 3.700 antes de Cristo se fermentaban cereales. Son 4 las principales características que ponen de relieve el uso de masas fermentadas en nuestra alimentación:
- Cualidades sensoriales: buena textura, aroma y sabor.
- Preservación: generación de ácidos o alcoholes que retrasan la caducidad.
- Seguridad: generación de sustancias antimicrobianas.
- Valor nutricional: bajos niveles de antinutrientes y alto contenido en vitaminas.
La obtención de una masa fermentada sólo requiere mezclar agua con harina y esperar. Una vez que comienza la fermentación, el pH cae haciendo aumentar la acidez de la mezcla. A partir de ahí es necesario refrescar varias veces añadiendo más agua y harina y seleccionar los microorganismos adecuados para obtener un buen producto. El proceso implica sobre todo tiempo. El típico pan de centeno alemán se realiza en 3 etapas y requiere entre 24 y 30 horas.
La levadura de panadería es el microorganismo más empleado en la obtención de masas fermentadas. Es el principal fermento utilizado en el malteado de la cebada para la elaboración de cerveza, y se extendió al ámbito de la panadería durante la Segunda Guerra Mundial, en la que se utilizó cebada para elaborar pan, dada la escasez de trigo.
En los últimos 100 años, y especialmente a partir de la década de 1960, los tiempos de fermentación se han llegado a reducir de las 30 horas a tan sólo 30 minutos, por lo que es difícil encontrar en la actualidad panes en los que la masa haya experimentado el proceso de fermentación necesario para otorgar las propiedades antes citadas.
Tras esta presentación e introducción a las masas fermentadas, el congreso entró ya en las cuestiones más técnicas relativas a la detección y cuantificación de gluten en alimentos, imprescindible para garantizar la seguridad de los productos comercializados sin gluten. La Dra. Katharina Scherf (Instituto Leibniz de Biología de Alimentos, Universidad Técnica de Munich, Alemania) recordó que el gluten es una proteína altamente compleja, con regiones totalmente inocuas y regiones con una toxicidad variable para las personas celíacas. La proporción de estas regiones varía además de unos cereales a otros y también de unos alimentos a otros según su composición y también en función de su procesamiento, que puede inducir cambios en los fragmentos de gluten aumentando o reduciendo su toxicidad.
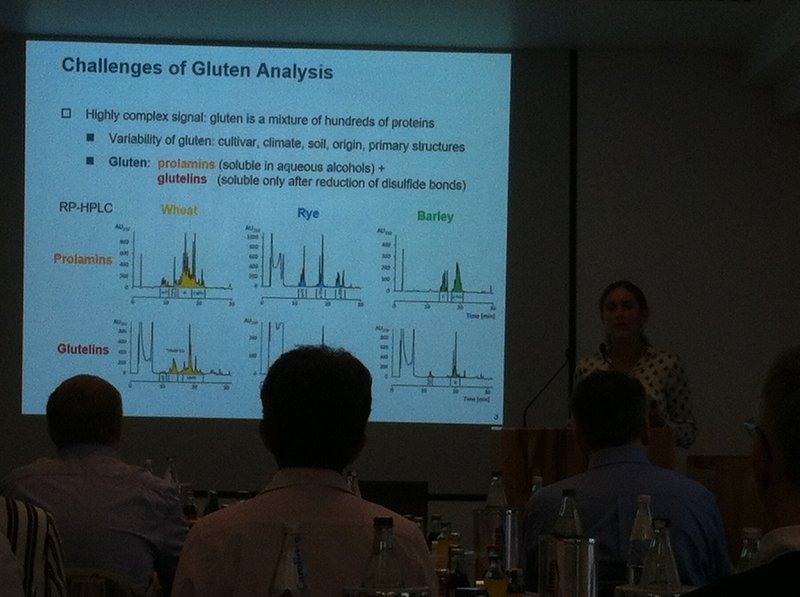
Los métodos de detección y cuantificación vigentes son inmunológicos y están automatizados con la técnica ELISA (Enzyme Linked Immuno Sorbent Assay), que utiliza diferentes anticuerpos para reconocer específicamente determinados fragmentos tóxicos del gluten de trigo, cebada y centeno, con diferente afinidad según el anticuerpo empleado. Actualmente, el único anticuerpo autorizado por la legislación vigente para este fin se denomina R5, que tiene un límite de cuantificación de 3 miligramos de gluten por kilo de producto. Anteriormente se empleaban otros, como el Skerrit, y actualmente el anticuerpo G12 busca hacerse hueco en este campo.
Estos anticuerpos detectan las gliadinas del trigo y péptidos similares de cebada y centeno (incluso avena), que son los fragmentos de gluten solubles en soluciones alcohólicas, pero no detectan las gluteninas (insolubles). Se estima que gliadinas y gluteninas se encuentran en el gluten en una proporción similar, por lo que la norma es multiplicar por dos el resultado de la cuantificación de gliadinas para estimar la cantidad real de gluten (gliadinas+gluteninas) presente en un alimento.
A pesar de ello, la medida es incierta, pues no existe ningún método alternativo que cuantifique fiablemente la cantidad real de gluten con el que comparar el resultado de ELISA-R5, y los métodos se calibran utilizando los denominados “materiales de referencia”, que son muestras con una cantidad de gluten conocida. Y otro factor que puede falsear el resultado es el hecho de que la proporción entre gliadinas y gluteninas no siempre está equilibrada, hay productos manufacturados con mayor cantidad de gliadinas que de gluteninas y viceversa.
Esta situación fomenta el desarrollo de métodos alternativos. Uno de ellos es la espectrometría de masas, capaz de identificar cualquier fragmento proteico tras la extracción de las proteínas de la muestra por cromatografía líquida (LC-MS, Liquid Chromatography – Mass Spectrometry).

Para ello es necesario caracterizar antes el gluten de trigo, cebada y centeno utilizando esta técnica. Ello requiere primero eliminar las grasas del grano y después otras proteínas como albúminas y globulinas. Después se procede a la digestión del gluten con enzimas como la tripsina y la quimiotripsina para posteriormente separar por cromatografía (HPLC, High Performance Liquid Chromatography) los fragmentos proteicos generados. Estos fragmentos de gluten son entonces sometidos a la espectrometría de masas que, acoplada a un sistema bioinformático, puede detectar si están presentes péptidos concretos (por ejemplo, aquellos que ya sabemos que son tóxicos para los celíacos) o bien chequear todos ellos y almacenarlos en una base de datos en caso de no haber sido identificados previamente. Así, el resultado de analizar un alimento se coteja en dicha base de datos para calcular su contenido en gluten.
Esta metodología tiene una sensibilidad muy alta, siendo capaz de cuantificar hasta 0,03 miligramos de proteína por kilo, detecta tanto gliadinas como gluteninas e incluso identifica el cereal de origen, pero es muy costosa y requiere personal cualificado. Por este motivo, es poco viable aplicar esta tecnología en el control analítico rutinario de alimentos, pero tiene otros usos, tanto en investigación como control de calidad.
El Dr. Twan America (Universidad de Wageningen, Holanda) analizó con este método la toxicidad de 6 variedades de trigo panadero, un cereal hexaploide que acumula 3 genomas diploides antiguos (A, B y D), 5 mezclas de variedades de este trigo y 16 variedades de espelta o trigo duro, que son variedades antiguas de trigo, tetraploides, que contienen los genomas A y B. Se fijó en 10 péptidos de la gliadina conocidos por su toxicidad y comprobó que 2 de ellos estaban presentes en todas las variedades analizadas y 4 eran exclusivos de los trigos panaderos. Además, ha podido demostrar que es un método muy bueno para discriminar entre variedades puras y mezclas, detectando contaminaciones de sólo el 5%. Esta técnica ha permitido, además, detectar péptidos muy similares a los péptidos tóxicos de gluten en muestras líquidas como la cerveza, una señal de alerta sobre la seguridad de estos productos, considerando además que la biodisponibilidad de proteínas es mayor cuando se ingieren en productos líquidos que cuando están en alimentos sólidos, según expuso la Dra. Michelle Colgrave (Brisvane, Australia).
Otro aspecto a tener en cuenta es que la toxicidad de la materia prima persiste en el producto manufacturado, pero no así la capacidad de detectarla en uno y otro caso con el método ELISA-R5. La Dra. Tanja Schirmer (Freising, Alemania) estudió por qué, y concluyó que durante la elaboración de pan algunas gliadinas pierden solubilidad, de forma que al extraer el gluten de la muestra de pan para analizarlo utilizando soluciones alcohólicas, que es lo habitual, parte de las gliadinas son desechadas junto con las gluteninas, que son insolubles, y por tanto no se detectan ni cuantifican cuando realmente están presentes y siguen siendo tóxicas. Lo observó al comparar los resultados de analizar gluten en la harina antes y después de su panificación: en la muestra horneada parecía haber menos gliadinas y más gluteninas que en la materia prima. La espectrometría de masas fue la que reveló el motivo.
Pero la pérdida de solubilidad de las gliadinas durante el procesamiento de la materia prima, que lleva a subestimar el contenido de gluten tóxico en una muestra, no es el único riesgo asociado a los procesos industriales. Según expuso el Dr. Oliver Tranquet (Nantes, Francia), la hidrólisis ácida de las proteínas de trigo favorece la desamidación de las gliadinas, transformando los aminoácidos de glutamina en ácido glutámico (lo mismo que hace la enzima transglutaminasa en el intestino de los celíacos cuando consumen gluten). Este cambio, que afecta en promedio al 25% de la proteína sometida a hidrólisis, supone un aumento real de la toxicidad inicial de la materia prima, al conferir al gluten una mayor capacidad para inducir respuestas inmunológicas adversas. De hecho, en 2003 se describió el primer caso de alergia frente a proteínas hidrolizadas de trigo (HWP, Hydrolized Wheat Proteins), con elevación de inmunoglobulina E (IgE) específica de dichas proteínas en sangre. La empresa INRA, donde trabaja el Dr. Tranquet, está desarrollando anticuerpos que detecten de forma específica las regiones de gluten que hayan sido desamidadas por este proceso para estimar su toxicidad y prevenir posibles reacciones alérgicas.
Y volviendo la mirada al pasado, el Triticum monococcum o Einkorn es el primer cereal de la historia en ser cultivado y se investiga como alternativa sin gluten al trigo actual. Se trata de una especie de trigo ancestral, diploide (sólo tiene 14 parejas de cromosomas), que presenta mayor diversidad que el trigo actual, soporta condiciones ambientales adversas, conserva su cáscara aún cuando ya está maduro y ofrece un bajo rendimiento. Así lo presentó la Dra. Zsófia Birinyi (Martonvásár, Hungría), en cuyo país se utiliza para elaborar cerveza. La toxicidad del gluten que contiene es mucho menor a la que se detecta en el trigo actual, la cebada o el centeno, según los métodos inmunológicos basados en los anticuerpos R5 y G12, pero no se considera apto para celíacos salvo que sea sometido a procesos de digestión enzimática o de fermentación con masa madre.

Sesión clínica
El Dr. Knut Lundin (Oslo, Noruega) ofreció algunos datos interesantes sobre la relación entre el gluten y la enfermedad celíaca. Desde 1993 se sabe que el gluten es reconocido por células T CD4+ en las personas celíacas, y en 2012 se estudió el tiempo necesario para observar cambios clínicos, serológicos e histológicos en adultos celíacos tras una reintroducción del gluten en su dieta. Las vellosidades intestinales comienzan a acortarse a las dos semanas, momento en el que empiezan a elevarse los anticuerpos en sangre, y los síntomas aparecen en un rango de tiempo que oscila entre los 3 y los 14 días. Además, todos los celíacos poseen en el intestino células T con especificidad para detectar gluten que se encuentran en situación de prealerta y son movilizadas rápidamente tras la reintroducción de gluten. Estas células T pueden ser detectadas en sangre a los pocos días utilizando una nueva metodología basada en los denominados ‘tetrámeros’, unos complejos proteicos capaces de anclarse a ellas para evidenciar su presencia. Y también en sangre pueden detectarse mediadores inmunológicos, las citoquinas, tan sólo 4 horas después de la reintroducción del gluten, como las interleuquinas IL-2, IL-8 e IL-10.
Respecto a la sensibilidad al gluten no celíaca, la definió como una reacción específica frente al gluten o frente a algún otro componente del trigo. Reservó el término ‘intolerancia al gluten’ para referirse, de manera más amplia, a cualquier reacción adversa frente al gluten o, según matizó, frente a los alimentos que lo contienen.
Que sea el gluten o que sea otro componente del trigo el causante de la sensibilidad al gluten no celíaca es algo que aún se investiga. Cuando se realizan ensayos cruzados doble-ciego controlados con placebo se comprueba que el gluten realmente no tiene ningún efecto diferente del placebo, mientras que los FODMAP (los fructanos en el caso del trigo) sí que parecen tener un efecto. Estos ensayos se realizan con pacientes con sensibilidad al gluten no celíaca que han mejorado al hacer dieta sin gluten. Sin abandonar esta dieta, se les divide en varios grupos al azar a los que se administra secuencialmente gluten, placebo y FODMAP, en un orden diferente para cada grupo, que los participantes desconocen. El periodo de administración de cada componente es de una semana y se deja otra semana entre un componente y el siguiente. La reaparición de los síntomas se produce invariablemente tras la administración de los FODMAP, consistentes en 2 gramos de fructanos al día y no cuando el elemento administrado ha sido el gluten o el placebo.
Volviendo al diagnóstico de la enfermedad celíaca, el Dr. Anil K. Verma (Universidad Politécnica delle Marche, Ancona, Italia) presentó los resultados de un estudio de prevalencia de enfermedad celíaca en escolares italianos, para el que aplicaron el siguiente protocolo, aprovechando la disponibilidad de tests genéticos rápidos y poco costosos, y que sugieren como estrategia para programas de cribado.
- Realizar estudio genético HLA-DQ.
- Resultado negativo para DQ2 y DQ8: enfermedad celíaca descartada.
- Resultado positivo para DQ2 y/o DQ8: seguir con el punto 2.
- Analizar IgA total en sangre.
- Valor normal: seguir con el punto 3.
- Déficit de IgA: saltar al punto 4.
- Analizar anticuerpos IgA antitransglutaminasa en sangre.
- Resultado negativo: enfermedad celíaca descartada.
- Resultado positivo: saltar al punto 5.
- Analizar anticuerpos IgG antipéptidos desamidados de gliadina en sangre.
- Resultado negativo: enfermedad celíaca descartada.
- Resultado positivo: saltar al punto 6.
- Analizar anticuerpos IgA antiendomisio en sangre.
- Resultado negativo: realizar un seguimiento del paciente.
- Resultado positivo: seguir con el punto 6.
- Realizar biopsia intestinal.
- Resultado negativo: realizar un seguimiento del paciente.
- Resultado positivo: enfermedad celíaca confirmada.
De esta forma han observado que el 42,9% de los escolares analizados tiene predisposición genética y el 2,5% presenta valores elevados de anticuerpos en sangre, situándose la prevalencia de la enfermedad celíaca detectada mediante cribado entre un 1,2% y un 1,9%.
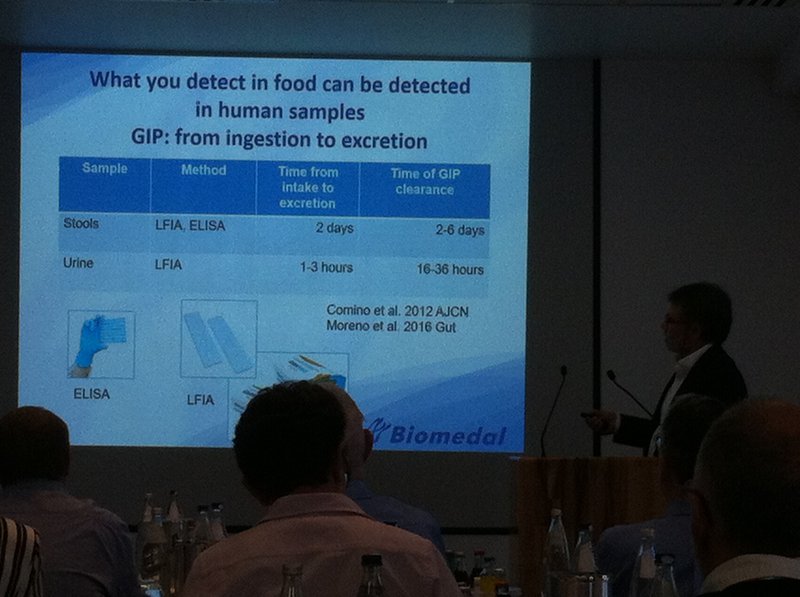
Por otro lado, el Dr. Ángel Cebolla (Sevilla, España) presentó la metodología novedosa que ha desarrollado su empresa, Biomedal S.L., para revelar de forma inequívoca la ingestión de gluten (accidental o intencionada) de pacientes celíacos que creen o aseguran estar haciendo bien la dieta sin gluten. Se trata de los tests que detectan gluten en las heces, desarrollados hace unos años, y otros más recientes que detectan gluten en la orina. En el primer caso, el gluten puede ser detectado dos días después de haber sido consumido, y sigue siendo detectable hasta 6 días después. En el caso de la orina, ya es detectable transcurridas entre 1 y 3 horas de su consumo, y deja de ser detectable al cabo de entre 16 y 36 horas. Justifica la necesidad de estos test para el control del buen cumplimiento de la dieta sin gluten con dos argumentos: 1) El riesgo de ingesta accidental es muy elevado, teniendo en cuenta que se realizan 1500 comidas al año (más de 100 fuera de casa) y se consumen más de 50 platos diferentes cada semana, según su estimación; 2) El método vigente para evidenciar una trasgresión, los anticuerpos antitransglutaminasa en sangre, frecuentemente ofrece resultados negativos a pesar de haber consumido gluten, cuando ocurre de forma ocasional.
Además, el Dr. Cebolla aprovechó su intervención para poner en valor su metodología de análisis de gluten en alimentos con el anticuerpo G12 que, aseguró, es equiparable al R5 en base a los estudios comparativos realizados hasta la fecha. Sostiene que la disparidad de resultados es mayor entre dos tests basados en R5 que entre cualquiera de los tests R5 y el G12. En la sesión dedicada a los aspectos legales, volvió a insistir en este hecho para defender este anticuerpo frente al R5 y que sea aprobado para el análisis de gluten en alimentos.
Y en cuanto a futuros tratamientos, el Dr. Detlef Schuppan (Universidad de Mainz, Alemania) presentó una nueva estrategia terapéutica que tiene previsto comenzar la fase 2 de los ensayos clínicos en este primer trimestre de 2018. Se trata de un fármaco experimental, ZED1227, desarrollado por la compañía Zedira para bloquear la enzima transglutaminasa 2 (TG2), responsable de la desamidación de las gliadinas del gluten, una modificación química de confiere al gluten una mayor capacidad para desencadenar una reacción inmunológica adversa en el intestino de los celíacos. El objetivo es permitir el consumo de entre 1 y 3 gramos de gluten al día. El ensayo se llevará a cabo durante 6 semanas con pacientes que consumirán cookies con 3 gramos de gluten al día.
Los ensayos preclínicos realizados en ratones ya habían probado la ausencia de toxicidad y la capacidad para bloquear la enzima TG2, cuya actividad reparadora de tejidos (la verdadera función de esta enzima) está compensada por una mayor actividad de enzimas similares, como las transglutaminasas TG3 y TG5. También se ha demostrado la escasa repercusión de este agente fuera del intestino, lo que sugiere que prácticamente no pasa a la sangre, lo que previene posibles efectos adversos en otras zonas del organismo.
Simposio: Papel de la microbiota intestinal en la enfermedad celíaca
La Dra. Elena Verdú (Universidad de McMaster, Hamilton, Canadá) comenzó este simposio indicando que el aumento de casos de enfermedad celíaca no sólo es debido al mejor diagnóstico tras la implantación de las pruebas serológicas de anticuerpos a raíz del descubrimiento de la transglutaminasa tisular como autoantígeno en esta enfermedad por parte del Dr. Detlef Schuppan. Otras enfermedades inflamatorias y autoinmunes también han ido en aumento.
En enfermedad celíaca hay disbiosis intestinal, una alteración de la composición microbiana del intestino relacionada con diversos factores ambientales, como las infecciones, el nacimiento por cesárea, el consumo de antibióticos o la administración de antiácidos inhibidores de la bomba de protones. Esta alteración se mantiene en pacientes que ya están haciendo dieta sin gluten pero que siguen con síntomas, en los que se observa una expansión de proteobacterias, muchas de ellas patógenas, como algunas cepas virulentas de Escherichia coli y bacterias oportunistas del género Neisseria y otros.

Por otro lado, desde hace casi dos décadas se sabe que el gluten no puede ser completamente degradado por las enzimas digestivas del intestino humano, y más recientemente se demostró que las bacterias intestinales contribuyen a su digestión, y además lo hacen de manera diferente según se trate de sujetos celíacos o de individuos sanos. En ratones libres de gérmenes, el gluten es degradado lentamente, pero su digestión se acelera cuando el intestino de estos ratones es colonizado por bacterias extraídas del intestino de pacientes celíacos, después de haber seleccionado aquellas que se alimentan exclusivamente de gluten (para ello basta con incubar las bacterias intestinales humanas en un medio de cultivo con el gluten como única fuente de nitrógeno). Además, los fragmentos proteicos resultantes de la digestión son los mismos en los celíacos y en los ratones colonizados con sus bacterias.
Pero una mayor actividad degradadora de gluten no implica que esta proteína pierda su toxicidad. Así se comprueba en estos ratones libres de gérmenes. Cuando son colonizados por bacterias del género Pseudomonas se generan péptidos que pueden ser desamidados por la enzima transglutaminasa y adquirir así una alta toxicidad para los celíacos, por su gran capacidad para hacer reaccionar su sistema inmunológico. Ahora bien, si estos péptidos son después sometidos a la actividad de bacterias del género Lactobacillus, su toxicidad se reduce notablemente. Por tanto, la proporción de estos grupos bacterianos determina en parte el potencial tóxico del gluten ingerido, y la acción conjunta o secuencial de unas u otras también.
Finalmente, la Dra. Verdú alertó sobre el impacto de ciertas intervenciones dietéticas y farmacológicas sobre la composición de la microbiota. Las dietas bajas en carbohidratos o hiperproteicas promueven cambios irreversibles, y el consumo de inhibidores de la bomba de protones como el antiácido Omeprazol da lugar, con 20 miligramos al día, a un sobrecremiento bacteriano en tan sólo 2 semanas.
Sobre el efecto de la dieta habló también la Dra. Walburga Dieterich (Erlangen, Alemania), quien afirmó que el 60% de los pacientes con síndrome de intestino irritable experimentan los síntomas después de las comidas. Las dietas habituales para estos pacientes recomiendan reducir su contenido en grasas y los alimentos que favorecen la generación de gases, como la cebolla o las legumbres. En la Universidad de Erlangen se estudió el efecto de dietas restrictivas en 19 pacientes con sensibilidad al gluten no celíaca y en 10 sujetos sanos. Concretamente se les puso a dieta baja en FODMAP durante dos semanas y, después de 5 días de dieta normal, otras dos semanas tuvieron que hacer dieta sin gluten. Ambas dietas hicieron mejorar los síntomas de los pacientes.

A modo de resumen, la Dra. Yolanda Sanz (Instituto de Agroquímica y Tecnología de Alimentos del CSIC, Valencia, España), comentó que la mayor abundancia de proteobacterias descrita en pacientes con enfermedad celíaca y en los que siguen dieta sin gluten pero con persistencia de síntomas no se observa en pacientes con dermatitis herpetiforme (la denominada ‘enfermedad celíaca de la piel’. Por otro lado, el estudio Proficel mostró que el aumento de Staphylococcus y la disminución de Lactobacillus incrementan el riesgo de enfermedad celíaca. Y el efecto protector de la leche materna, evaluado en el proyecto Prevent CD, junto con la introducción temprana del gluten, no ha sido probado en el caso de la enfermedad celíaca.
Aspectos legales
Este apartado se dedicó principalmente al debate sobre el anticuerpo G12 y su solicitud de aprobación como método de análisis de gluten en alimentos.
Paul Wehling (Minneapolis, Estados Unidos), director científico de General Mills, el mayor productor de alimentos sin gluten en Norteamérica, fue el encargado de recopilar los datos disponibles para discutir sobre la idoneidad del anticuerpo G12 para este fin. Se basó en los resultados de los estudios comparativos que lleva a cabo FAPAS, un organismo internacional acreditado, dedicado a asesorar a laboratorios que realizan analíticas de alimentos, que estudia la concordancia de resultados entre laboratorios a los que suministran muestras con cantidades conocidas de la sustancia en cuestión para su análisis, en este caso gluten.
Destacó, no obstante, que estos estudios, denominados Proficiency Testing Studies, no tienen la finalidad de comparar métodos, sino laboratorios, cada uno de los cuales utiliza el método que considera más adecuado de entre los muchos existentes en el mercado basados en uno u otro anticuerpo.
En este caso se dispuso de 1.289 resultados analíticos obtenidos con 11 métodos diferentes y correspondían a 13 muestras con cantidades conocidas de gluten: 8 productos de pastelería, 3 productos infantiles de fórmula con soja y 2 productos de avena. La comparación estadística entre los resultados obtenidos con metodologías basadas en el anticuerpo G12 y los basados en el R5 fue complicada dada la escasez de datos basados en el G12. A pesar de ello, se pudo concluir que las mayores discrepancias entre R5 y G12 se dan al analizar los productos de pastelería, no existiendo grandes diferencias en las fórmulas infantiles o en los productos de avena.
En cualquier caso, por ahora no considera equiparables los métodos basados en uno y otro anticuerpo, y el test que menor variabilidad ofreció entre laboratorios, basado en el anticuerpo R5, fue el kit R7001 de la compañía alemana R-Biopharm.
El Dr. Cebolla, cuya compañía, Biomedal S.L., fue la que desarrolló el anticuerpo G12, adujo que la falta de estudios basados en su anticuerpo se debe precisamente a que no es un método aprobado para analizar gluten en alimentos, por lo que los laboratorios no lo usan, y no lo harán mientras no sea aprobado, lo que dificulta las comparativas con R5. Además, recordó que los estudios de validación a los que se ha sometido el anticuerpo G12 hasta la fecha, en los que han participado más de una decena de laboratorios independientes, muestran mayores discrepancias entre algunos kits basados en R5 de los disponibles en el mercado que entre cualquiera de ellos y el G12.
Hertha Deutsch, quien preside la asociación de celíacos de Austria y ejerce como observadora de la asociación de celíacos de Europa (AOECS, Association of European Coeliac Societies) en las comisiones del Codex Alimentarius, actuó como moderadora en este debate y explicó los aspectos legales que afectan a este asunto, así como los pasos que se han dado para solicitar la aprobación de G12 como método analítico.
Según se establece en el Codex, los métodos analíticos se clasifican en los tipos 1, 2, 3 y 4. El tipo 1 es el de elección para el análisis y debe ser único. El tipo 2 es el de referencia para calibrar los tests y el tipo 3 es un método alternativo que también debe ser aprobado. En 2008, el Codex aprobó como método tipo 1 para analizar gluten en alimentos el ensayo inmunológico ELISA basado en el anticuerpo R5, el único disponible en ese momento, por indicación del grupo WGPAT, surgido en 1970 precisamente para desarrollar y ofrecer al Codex métodos analíticos para el gluten. Hasta entonces se empleaba el método de detección de nitrógeno, menos específico y en vigor desde 1979.
Más allá de la concordancia o no de resultados entre R5 y G12, tal vez el principal motivo que invalida este último como método tipo 1 es que incurre en una contradicción. G12 se presenta como un anticuerpo que detecta específicamente el péptido 33mer, el fragmento de gluten más tóxico para los celíacos, pero también asegura detectar avena. Teniendo en cuenta que la avena carece de este péptido, implícitamente está reconociendo que existe reactividad cruzada, y esto el Codex no lo permite en métodos tipo 1. Así lo expuso uno de los presentes, y fue apoyado por un investigador de la empresa R-Biopharm, proveedor de uno de los kits basados en R5 que más se comercializan.
Pero no es la única contradicción que salió a la luz en la sala. El Codex está obligado a revisar periódicamente los métodos analíticos de referencia y contempla la sustitución de unos por otros sin especificar cuáles deben ser. En el caso que nos ocupa, exige que cualquier nuevo método que aspire a ser tipo 1 debe ofrecer resultados equivalentes al método vigente, ELISA-R5, lo que implícitamente obliga a que el método candidato sea de tipo inmunológico, cualquier otro (genético, proteómico, etc.) no podría ofrecer un ‘resultado equivalente’, al tratarse de técnicas de medida totalmente diferentes. Así lo expresó otro de los presentes, insinuando que la literalidad de la norma puede emplearse tanto a favor como en contra de cualquier intento de avance. La discusión sigue abierta.
Por otro lado, y para concluir, se comentó que en marzo de 2017 quedaron consensuados los requerimientos que deben cumplir los kits que se desarrollen para analizar gluten en productos basados en avena. El límite de detección y cuantificación debe ser 5 miligramos y el rango de recuperación entre el 50% y el 200%, tal como se aplica también a productos basados en trigo, cebada y centeno. Además, el grupo de trabajo WGPAT estableció que la concentración de gluten en muestras contaminadas intencionadamente para su análisis, destinadas a la validación de los kits, debe ser estimada con el método de Dumas, que detecta el contenido de nitrógeno, mejor que con la técnica cromatográfica HPLC o con cualquier otra metodología.
Autor: Juan Ignacio Serrano Vela. Doctor en Biología.