NOTICIAS
Resumen: 17th International Celiac Disease Symposium (ICDS)

En el mes de septiembre tuvo lugar el congreso más relevante que se celebra a nivel mundial sobre enfermedad celíaca, el Simposio Internacional sobre Enfermedad Celíaca que organiza cada dos años la Sociedad Internacional para el Estudio de la Enfermedad Celíaca (ISSCD, International Society for the Study of Celiac Disease), y que en su decimoséptima edición se trasladó por primera vez al continente asiático.

A continuación, exponemos los temas más interesantes que se trataron en este congreso.
Epidemiología
El dato de prevalencia de enfermedad celíaca más consolidado es el 1% en la mayoría de los países en los que se ha estimado, aunque existen diferencias notables, desde el 0,2% de Alemania hasta el 5-6% de la población saharaui, pasando por un 2% en Finlandia, tal y como expuso el Dr. Carlo Catassi (Universidad Politécnica delle Marche de Ancona, Italia). En Japón y Vietnam no se han detectado casos de enfermedad celíaca. La prevalencia de la enfermedad en distintas regiones depende de la constitución genética HLA de la población estudiada, de sus hábitos de consumo de gluten y de otros factores ambientales, como el tipo de parto, las infecciones intestinales a edades muy tempranas, el consumo de antibióticos o incluso los procesos de fermentación de las masas empleadas al elaborar productos de alimentación. Además, el protocolo de selección de sujetos para estos estudios puede implicar sesgos que afectan también al resultado. Un ejemplo habitual es aprovechar las muestras de sangre de los donantes para analizar anticuerpos y detectar posibles casos de enfermedad celíaca. La ventaja es la alta disponibilidad de muestras, la desventaja es que los donantes de sangre no son una muestra representativa de la población.

Los datos más recientes obtenidos en Italia a partir de cerca de 5.000 escolares estudiados entre 2015 y 2016, muestran una prevalencia del 1,5% y un porcentaje de casos no diagnosticados que aún supera el 70%. En este trabajo, liderado por el Dr. Anil Verma (Universidad Politécnica delle Marche de Ancona, Italia), el primer paso fue el estudio genético. A los casos positivos (el 42%) se les realizó al análisis de anticuerpos en sangre, y los que resultaron positivos (el 2,5%) fueron sometidos a una biopsia intestinal, confirmándose la enfermedad en un 1,5% del grupo de partida.
Actualmente, hasta un 13% de los italianos hacen dieta sin gluten, entre pacientes diagnosticados de enfermedad celíaca (0,8%), pacientes diagnosticados de sensibilidad al gluten no celíaca (3%) y personas que han dejado de consumir gluten por cuenta propia (9,2%).
Factores de riesgo
El estudio TEDDY (The Environmental Determinants of Diabetes in the Young), diseñado para identificar factores implicados en el desarrollo de la diabetes tipo 1, ha permitido estudiar en paralelo la enfermedad celíaca, dada la base genética común a ambas enfermedades y que fue el criterio de selección de los sujetos para el estudio, como expuso el Dr. Daniel Agardh (Universidad de Lund, Suecia). Tras seguir hasta la edad de 15 años a 8.676 niños reclutados entre 2004 y 2010 en Finlandia, Suecia, Alemania y en 3 estados de Estados Unidos, se ha podido constatar que el riesgo de desarrollar enfermedad celíaca es 3,6 veces superior si se tiene algún familiar celíaco, independientemente de qué familiar se trate o del número de familiares afectados.
Por otra parte, el incremento del riesgo de enfermedad celíaca asociado tradicionalmente a infecciones digestivas sufridas antes de los 18 meses de vida se ha comprobado que se cumple en los nacidos en primavera, pero no en los nacidos en otoño, según expuso este investigador sueco a raíz de los resultados que se van extrayendo de otro estudio prospectivo, el estudio MoBa (The Norwegian Mother and Child Cohort Study), que está siguiendo la evolución de más de 100.000 nacidos entre 1999 y 2008 en Noruega.
En cuanto a la vacunación frente al Rotavirus, uno de los principales sospechosos de esta asociación, se ha comprobado que no protege contra la enfermedad celíaca salvo que el gluten haya sido introducido antes del 6º mes, al menos en los países en los que se han ensayado dos nuevas versiones de esta vacuna: Alemania, Finlandia y Estados Unidos.
Y siguiendo con las infecciones como posibles detonantes de la enfermedad, la Dra. Valentina Discepolo (Universidad de Chicago, Estados Unidos) explicó cómo una infección viral inocua, provocada por un Reovirus intestinal, puede alterar el sistema inmunológico causando la pérdida de tolerancia inmunológica ante proteínas de la dieta, como el gluten, favoreciendo la reacción adversa que da lugar a la enfermedad celíaca, uno de los grandes descubrimientos de este año.
Prevención
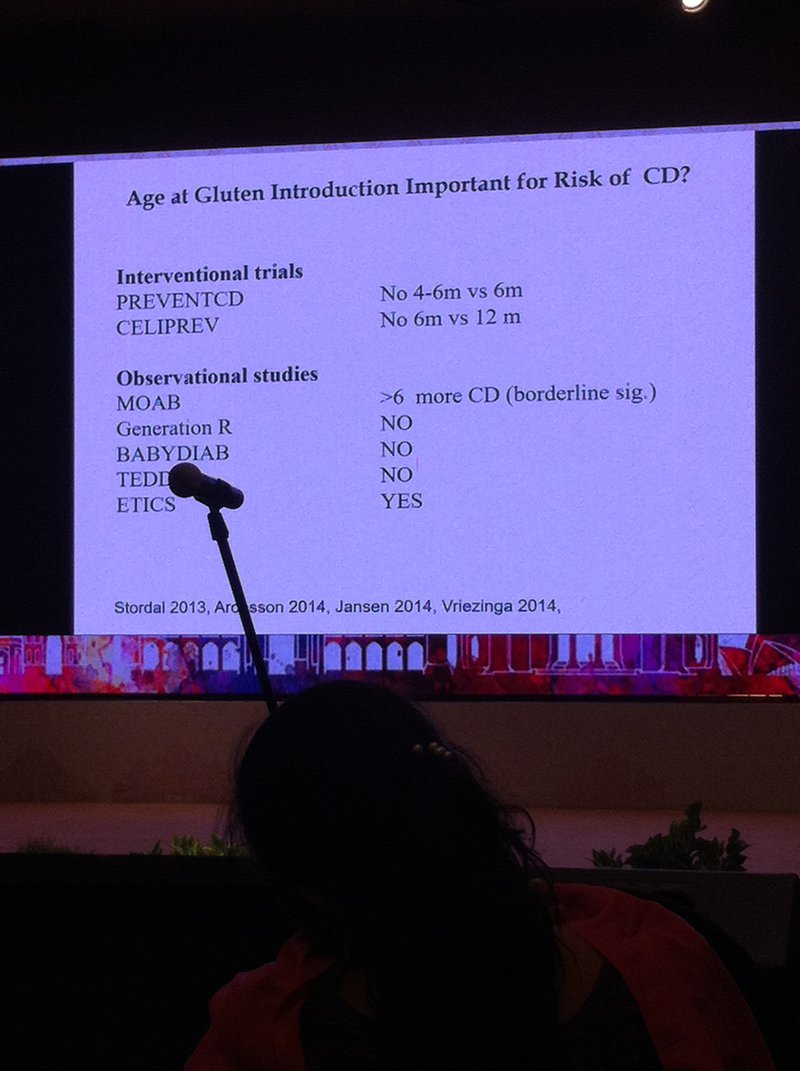
La Dra. María Luisa Mearin (Centro Médico Universitario de Leiden, Holanda) recordó las novedades relacionadas con la introducción de gluten en bebés y el papel de la lactancia materna. Si bien las evidencias previas sugerían que la introducción temprana (antes del 4º mes) o tardía (después del 7º mes) del gluten en bebés y la ausencia de lactancia materna incrementaban el riesgo de desarrollo de enfermedad celíaca, las investigaciones más recientes han demostrado que no. El proyecto Prevent CD, que se ha desarrollado en Europa para evaluar de forma prospectiva estos factores, ha obligado a desmentir esta idea, a pesar de lo cual se sigue recomendando, como hasta ahora, introducir el gluten de forma paulatina hacia el sexto mes de vida y hacerlo coincidir en la medida de lo posible con la lactancia materna.

De este estudio se han extraído otras conclusiones interesantes, como que los hábitos alimenticios o la cantidad de gluten ingerida tampoco parece determinante. Por ejemplo, no se han observado diferencias de riesgo entre España, donde la cantidad consumida es baja y sostenida en el tiempo, Holanda, donde es más elevada pero también estable en el tiempo, o Italia, donde la cantidad que se ingiere se va incrementando con el tiempo en los bebés. Ahora se investiga si la presencia de anticuerpos antigliadina en la leche materna de mujeres celíacas incide en el riesgo de desarrollo de la enfermedad celíaca en sus hijos.
Diagnóstico en edad pediátrica
El Dr. Stefano Guandalini, gastroenterólogo pediátrico en el Centro Médico vinculado a la Universidad de Chicago, en Estados Unidos, inició su ponencia relatando la evolución histórica del diagnóstico de la enfermedad celíaca desde que se comenzaron a hacer biopsias duodenales hasta ahora que la biopsia es prescindible en algunos casos en edad pediátrica.
Según relató, en la década de 1950, cuando la enfermedad celíaca era reconocida como un síndrome de malabsorción al que se aludía como “síndrome celíaco”, la Dra. Margot Shiner, fundadora de la especialidad de Gastroenterología Pediátrica, publicó la biopsia de duodeno como técnica diagnóstica (The Lancet, 1956) y un año después el primer caso de enfermedad celíaca diagnosticada con dicha técnica en niños (The Lancet, 1957).
En la década de 1960 la atrofia de vellosidades intestinales es ya considerada el rasgo definitorio de la enfermedad celíaca, y se funda la Sociedad Europea de Gastroenterología Pediátrica (ESPGA, European Society for Pediatric Gastroenterology), que más tarde dio lugar a la ESPGAN (que incorpora la especialidad de Nutrición) y a la actual ESPGHAN (que incluye también la especialidad de Hepatología). Esta sociedad científica es la responsable de publicar las guías de diagnóstico de la enfermedad celíaca, la primera de ellas en 1969 tras la reunión de un comité de expertos en Interlaken (Suiza). Se iniciaba la época en la que el diagnóstico requería realizar 3 biopsias, la primera en el momento de sospechar la enfermedad, la segunda tras 12 meses haciendo dieta sin gluten y una tercera tras reintroducir el gluten durante tres meses, la conocida como prueba de provocación.
En la década de 1980 se incorpora el estudio de anticuerpos antiendomisio para el diagnóstico de la enfermedad celíaca, que ahora ya se considera que puede presentarse con síntomas extradigestivos, y da pie a la actualización de los criterios de diagnóstico, que se publican en 1990 y reducen a uno el número de biopsias necesarias para el diagnóstico, siempre que se disponga del resultado de estos anticuerpos y de una evaluación clínica adecuada.

La mejora en los tests serológicos que detectan en sangre anticuerpos específicos de la enfermedad, como los antitransglutaminasa y los antipéptidos desamidados de gliadina, da lugar a una nueva actualización de los criterios diagnósticos que se publica en 2012 y recoge por primera vez la posibilidad de diagnosticar sin biopsia a niños y adolescentes que cumplan 4 requisitos:
- Síntomas de sospecha de enfermedad celíaca.
- Anticuerpos IgA antitransglutaminasa en sangre con valores 10 por encima del valor normal.
- Anticuerpos IgA antiendomisio en sangre con valores positivos (deben ser analizados en una muestra de sangre diferente de la anterior).
- Predisposición genética (presencia de las variantes de riesgo DQ2 o DQ8 o ambas a la vez).
Estos criterios han generado cierta controversia y desde su publicación se ha llevado a cabo en Europa un estudio prospectivo, el estudio ProCeDE (Prospective Celiac Disease Diagnostic Evaluation), para evaluar su fiabilidad. Los resultados se han publicado este año y de ellos se concluye que:
- El 50% de los niños correctamente diagnosticados de enfermedad celíaca entre diciembre de 2012 y mayo de 2014 lo han sido sin biopsia.
- La presencia en sangre de anticuerpos IgA antitransglutamniasa con valores 10 veces por encima del valor normal y de anticuerpos IgA antiendomisio con valores positivos predicen la enfermedad celíaca con una fiabilidad del 99% si existen síntomas de sospecha. Y si estos síntomas son los típicos de malabsorción (diarrea crónica, pérdida de peso, retraso de crecimiento, anemia), la capacidad predictiva asciende al 100%.
- Cumplidos los requisitos anteriores, el estudio genético resulta innecesario, ya que no aumenta la capacidad predictiva que por sí solos tienen los anticuerpos en presencia de síntomas de sospecha.
- La capacidad predictiva del análisis serológico no se ve afectada por el test de anticuerpos utilizado de entre los disponibles en el mercado.

No obstante, se producen errores de diagnóstico cuando se prescinde de la biopsia y se debe al incumplimiento de alguno de los 4 criterios mencionados. Así, se han diagnosticado sin biopsia casos que no presentaban síntomas o en los que no se había realizado el estudio genético o en los que los anticuerpos antiendomisio no habían sido valorados en una muestra de sangre diferente de la empleada para valorar los anticuerpos antitransglutaminasa.
Enfermedad celíaca potencial
El Dr. Ricardo Troncone (Universidad Federico II de Nápoles, Italia), destacó que la dieta sin gluten permite normalizar el crecimiento y los niveles de hierro y ácido fólico, así como la función ósea, en niños celíacos, aunque no ayuda en el control metabólico de la diabetes tipo 1 ni de sus complicaciones. Sin embargo, no siempre está claro cuándo prescribir esta dieta. Queda por resolver cómo actuar ante pacientes afectados por la denominada enfermedad celíaca potencial. Se trata de pacientes que tienen predisposición genética y valores positivos de anticuerpos en sangre, pero que no muestran atrofia de vellosidades cuando se les realiza la biopsia y generalmente tampoco manifiestan síntomas. Para conocer mejor cómo evolucionan estos pacientes si siguen consumiendo gluten, la Dra. Renata Auricchio (Universidad Federico II de Nápoles, Italia) siguió durante 10 años a 357 pacientes pediátricos que cumplían estos requisitos. Pudo comprobar que el 36% de ellos seguían en ese estado potencial después de 9 años, y los que evolucionaron hacia una típica enfermedad celíaca, con síntomas y atrofia de vellosidades, lo hicieron en los primeros dos años. En estos últimos era más común la presencia de combinaciones genéticas de mayor riesgo, la persistencia de anticuerpos positivos en sangre y la existencia de un infiltrado inflamatorio en la biopsia (lesión tipo 1 de Marsh). En general, se suele recomendar dieta sin gluten a este tipo de pacientes sólo si tienen síntomas, pero se discute si hacerlo en todos los casos con el fin de prevenir la aparición futura de la enfermedad.

Diagnóstico en edad adulta
En edad adulta el panorama es bastante diferente. El Dr. Peter Green, gastroenterólogo que dirige el centro especializado en enfermedad celíaca de la Universidad de Columbia, en Nueva York (Estados Unidos), comentó que es necesario evitar por un lado el infradiagnóstico para prevenir problemas de salud adicionales en los pacientes y un excesivo gasto sanitario, y por otro el sobrediagnóstico, que también conlleva un mayor gasto y supone una limitación social y de calidad de vida de los pacientes.
En este caso, los síntomas de malabsorción son mucho menos frecuentes y la capacidad predictiva del análisis de anticuerpos es muy inferior, por lo que no se contempla el diagnóstico sin biopsia. Según sus datos, el 36% de los adultos diagnosticados presentaban diarrea, el 13% anemia y el 5% mostraba alguna enfermedad ósea. El 8% eran asintomáticos y fueron detectados tras realizarles las pruebas por pertenecer a grupos de riesgo.
La capacidad predictiva de los anticuerpos anitransglutaminasa es sólo del 30% en población general, donde la prevalencia de la enfermedad es del 1%, y del 83,3% en grupos de riesgo, en los que la prevalencia ronda el 10%. La valoración de anticuerpos antipéptidos desamidados de gliadina aumenta la capacidad diagnóstica, siendo capaz de detectar la enfermedad en un 15% de sujetos con anticuerpos antitransglutaminasa negativos.
Respecto a la biopsia, la recomendación de tomar un mínimo de 4 muestras se cumple sólo en el 35% de los casos, y no siempre incluyen alguna del bulbo, única porción del duodeno que muestra algún tipo de lesión en el 13% de los celíacos.

Nuevos métodos de diagnóstico
Por todo ello se sigue investigando en busca de nuevos marcadores que permitan detectar la enfermedad de manera más precoz y fiable. El Dr. Shuo Wan Quiao (Universidad de Oslo, Noruega) presentó una de las novedades a este respecto. Se trata de detectar en sangre un tipo de linfocitos T que generan los celíacos tras haber entrado en contacto con el gluten y desencadenado la reacción adversa característica de la enfermedad. Dichos linfocitos mantienen una “memoria inmunológica” que les permite reconocer y reaccionar nuevamente frente al gluten en futuras exposiciones a esta proteína. Aunque sus niveles bajan rápidamente tras el inicio de la dieta sin gluten, pueden permanecer en la sangre transcurridos más de 20 años desde el inicio de la dieta y se pueden detectar utilizando unas moléculas artificiales con estructura de tetrámero formadas por fragmentos de gluten unidos a proteínas HLA-DQ2. La técnica es costosa y no fácilmente incorporable en la mayoría de laboratorios, por lo que se está explorando la identificación de secuencias de ADN que son características de estos linfocitos T como señal inequívoca de que el paciente es celíaco.

El Dr. Alka Kumarin (India) también investiga nuevos marcadores de enfermedad celíaca que eviten técnicas invasivas como la biopsia. Utilizando como modelo de estudio pacientes de leucemia sometidos a tratamientos cíclicos con quimioterapia, que provocan también ciclos de destrucción y regeneración de su epitelio intestinal, ha seleccionado 3 marcadores: la citrulina, un péptido sintetizado por los enterocitos, la proteína intestinal transportadora de ácidos grasos I-FABP (intestinal fatty acids binding protein) y la proteína de regeneración celular Reg-1α. Ha comprobado que cuando se produce daño intestinal, disminuyen los niveles de citrulina en plasma, aumentan los niveles de I-FABP en plasma y aumentan los niveles de en Reg-1α suero. Trasladado este análisis a pacientes celíacos antes y después de hacer dieta sin gluten y comparado con otras patologías inflamatorias intestinales y con sujetos sanos, concluye que la disminución de citrulina en plasma por debajo de 30 microgramos/mililitro y la elevación de I-FABP en plasma por encima de 1.100 picogramos/mililitro ofrece unos valores de sensibilidad y especificidad del 89% y el 100%, respectivamente, para la detección de enferemdad celíaca sin biopsia.
Enfermedades asociadas
El Dr. Marios Hadjivassiliou, neurólogo en el hospital de Sheffield (Inglaterra), habló de la ataxia por gluten, uno de los problemas neurológicos más comúnes en enfermedad celíaca, que representa además el 20% de todas las ataxias y hasta el 51% de aquellas de causa no identificada. Aunque el diagnóstico es complicado dada la ausencia de marcadores, aproximadamente la mitad de los pacientes presentan anticuerpos antigliadina en sangre, siendo por el momento el único indicador de posible ataxia por gluten.
Muchos pacientes celíacos presentan problemas de coordinación, y al realizarles una resonancia magnética se observan alteraciones en el cerebelo hasta en un 46% de los casos. La aparición de ataxia en pacientes celíacos, o su complicación si ya estaba presente, se debe en la mayoría de los casos a un mal cumplimiento de la dieta sin gluten, y el efecto de la dieta sin gluten es difícil de valorar en pacientes con estados avanzados de ataxia. No obstante, es la única ataxia que puede mejorar si la dieta se hace correctamente.

Por otro lado, las enfermedades autoinmunes aparecen también con mayor frecuencia en pacientes celíacos. La Dra. Louise Grode (Universidad de Aarhus, Dinamarca) analizó el registro de pacientes celíacos de su país entre 1977 y 2016, en total 11.802 sujetos, y comprobó que el 16,4% padecía alguna enfermedad autoinmune, frente al 5,3% observado en población general. Además, pudo constatar que en los últimos 30 años la prevalencia de la enfermedad celiaca (diagnosticada) se ha duplicado cada 10 años.
Genética
La Dra. Cisca Wijmenga (Holanda) recordó que la información genética contenida en el ADN se transcribe en ARN mensajero para después traducirse a proteínas, que son las moléculas que finalmente ejercen una función biológica y determinan el fenotipo del individuo. Los genes que dan lugar a estas proteínas no se están expresando continuamente, y cuando lo hace no es con la misma intensidad ni en todos los tejidos del organismo, sino que lo hacen de forma selectiva dependiendo del tejido y del momento, lo cual depende de mecanismos de regulación de la expresión génica altamente complejos.
La búsqueda intensiva de marcadores genéticos asociados a enfermedad celíaca en los últimos años ha demostrado que la mayoría de ellos se encuentran fuera de los genes, lo que significa que no afectan directamente a la estructura ni a la función de ninguna proteína. Sin embargo, sí provocan alteraciones en funciones biológicas, y estas alteraciones son atribuibles a fallos en la regulación de la expresión de los genes que están involucrados en dichas funciones biológicas.
Poco a poco se van identificando las regiones del ADN que alojan secuencias reguladoras de la expresión génica y en las que se han detectado marcadores asociados a enfermedad celíaca. Las 3 principales son las que dan lugar a factores de transcripción, las que dan lugar a ARN largos no codificantes (lncRNA’s, long non coding RNA’s) y los enhancers o potenciadores de la expresión génica.

El estudio de los genes, su expresión y su interrelación para el desempeño de funciones biológicas es el objeto de la genómica funcional, y en este ámbito el Dr. Raminc Xavier (Estados Unidos) investiga los genes implicados en el aumento de la permeabilidad intestinal. Se trata de un rasgo tradicionalmente observado en los familiares de primer grado de los pacientes con enfermedad inflamatoria intestinal familiares, y también se da en los pacientes celiacos. Los genes que actualmente centran su interés son TRIM62 y CARD9, que han demostrado su asociación con enfermedades inmunológicas como la enfermedad inflamatoria intestinal.
En vista de los estudios epigenéticos que analizan diferentes patrones de metilación que modifican la expresión de genes asociados a enfermedad celíaca en comparación con sujetos sanos, el Dr. Luigi Greco (Italia) concluye con la siguiente frase: el verdadero fenotipo de la enfermedad celíaca es una expresión aumentada de genes inflamatorios y una expresión disminuida de genes relacionados con la integridad del epitelio intestinal. Los genes en los que ha observado estas diferencias de expresión son SH2B3 y el gen de interleucina 21 (IL21).
También se sugiere la existencia de un componente genético para explicar las diferencias en la composición microbiana del intestino (microbiota intestinal) entre sujetos sanos y pacientes celiacos. El Dr Rahul Bodkhe (India) ha comprobado al analizar la microbiota de personas sanas que tienen un familiar de primer grado con enfermedad celíaca que no difiere mucho de ellos. Además, recomienda estudiar la microbiota en la propia biopsia y no en las heces, pues existen diferencias entre ambas muestras de un mismo sujeto que pueden llevar a conclusiones erróneas.
Patogénesis
El Dr. Ludvig Sollid, director del Centro de Regulación Inmunológica de Oslo (Noruega), investiga el mecanismo que genera anticuerpos contra la transglutaminasa tisular, una enzima de nuestro propio intestino, y el papel de los linfocitos B que producen estos anticuerpos en la patogénesis de la enfermedad celíaca.
Las normas clásicas de la inmunología establecen que para que haya una producción de anticuerpos dirigidos específicamente contra algún fragmento proteico (péptido), ya sea propio o extraño, es necesaria la activación de unos linfocitos T que reconozcan específicamente dicho péptido a través de su receptor de superficie (TCR, T cell receptor). Además, este reconocimiento debe producirse cuando el péptido está unido, también de forma específica, a variantes concretas de la familia de proteínas HLA, que se encuentran ancladas a la superficie de células especializadas en la presentación de péptidos (antígenos), como las células dendríticas, los macrófagos o los linfocitos B. Este mecanismo de triple reconocimiento específico (TCR – péptido – HLA) es el que permite iniciar respuestas inmunológicas específicas frente al péptido en cuestión (o más bien frente a lo que dio origen a dicho péptido, como puede ser un virus, una bacteria o una célula tumoral).
En enfermedad celíaca, los únicos linfocitos T activados que se pueden detectar reconocen específicamente fragmentos de gluten (gliadinas) a través de su TCR, que les han sido presentados por las variantes proteicas HLA-DQ2 o HLA-DQ8. De ahí se deduce que la respuesta inmunológica que se activa va dirigida contra el gluten (o las gliadinas), como de hecho ocurre, pudiendo detectarse en sangre anticuerpos antigliadina y también los linfocitos B productores de estos anticuerpos.
Sin embargo, también hay linfocitos B que producen anticuerpos antitransglutaminasa, pueden ser detectados en sangre. Pero no se han podido identificar linfocitos T activos que reconozcan específicamente la enzima transglutaminasa a través de su TCR ni variantes proteicas HLA capaces de presentarla.
Por otro lado, el mediador inmunológico conocido como interleuquina 15 (IL15) tiene un papel central en la patogénesis de la enfermedad celíaca y, en general, en las enfermedades autoinmunes, según expuso la Dra. Bana Jabri (Universidad de Chicago, Estados Unidos). En el caso de la enfermedad celíaca, su expresión se encuentra incrementada tanto en el epitelio intestinal como en el espacio situado bajo él, la lámina propia. En esta segunda localización intestinal, los niveles altos de IL15 y de ácido retinoico tienen un efecto proinflamatorio cuando se produce la captura de fragmentos de proteínas alimentarias por parte de las células dendríticas, principales encargadas de la presentación de estos péptidos a los linfocitos T. Esta citoquina, además, impide que los linfocitos T reguladores (identificados por poseer el marcador FOXP3) bloqueen la activación de linfocitos T citotóxicos, que son los responsables de causar el daño intestinal. Se ha demostrado que la IL15 regula un complejo programa de expresión génica en estos linfocitos T citotóxicos.

Ante este panorama, deja de funcionar el mecanismo inmunológico conocido como “tolerancia oral frente a los antígenos (proteínas) de la dieta”. La Dra. Valentina Discepolo (Universidad de Chicago, Estados Unidos) arrojó un poco de luz sobre cómo puede ocurrir esto. Expuso los resultados del trabajo que ha podido demostrar por primera vez el mecanismo por el que una infección provocada por un virus intestinal puede provocar que el sistema inmunológico se vuelva reactivo frente al gluten. El trabajo se realizó con ratones y comprobó que la pérdida de tolerancia oral frente a proteínas de los alimentos se produce en dos etapas: una bloquea la generación de linfocitos T reguladores, en presencia de interferón 1 (IFN-1), y la otra promueve una respuesta inmunológica tipo Th1 (la característica de esta enfermedad) en presencia del factor regulador de interferón 1 (IRF-1).
Se trata de un reovirus completamente inofensivo para los humanos. La investigación en ratones ha demostrado que una variante de este virus produce la inmunización del individuo (que es lo esperable ante cualquier infección) y la pérdida de tolerancia oral (que es un efecto no deseado), mientras que otra variante del virus produce la inmunización, pero no la pérdida de tolerancia oral. Esto abre las puertas a terapias preventivas con vacunas basadas en esta segunda versión del virus. Aunque se ha investigado en ratones, se sospecha que en humanos tiene el mismo efecto, pues se ha comprobado que entre los celíacos hay más sujetos inmunizados frente a este reovirus que entre los sujetos sanos, indicando que al menos en algunos celíacos la infección viral ha sido el detonante de la enfermedad.
La investigación con ratones (o con otros animales de experimentación) es fundamental para desentrañar los mecanismos responsables de las enfermedades, pero para ello es necesario que la enfermedad en cuestión exista en el animal y se manifieste de la misma manera en que lo hace en humanos. En el caso de la enfermedad celíaca no es así y se ha trabajado mucho para lograr disponer de ratones como modelo de enfermedad celíaca. La Dra. Valerie Abadie (Universidad de Montreal, Canadá / Estados Unidos) presentó un modelo de ratón humanizado que expresa la variante proteica HLA-DQ8 y que cumple los requisitos mínimos para poder estudiar en él la enfermedad celíaca:
- Expresión elevada de IL15 en el epitelio y en la lámina propia.
- Activación inmunológica en respuesta al consumo de gluten dependiente de la presencia de proteínas HLA-DQ8 y de linfocitos T que reconocen gliadinas de forma específica.
- Aparición de anticuerpos antigliadina y antitransglutaminasa en sangre y de atrofia de vellosidades en el intestino en respuesta al consumo de gluten.
- Desaparición de los anticuerpos y de la atrofia en respuesta a la dieta sin gluten.
Es el modelo animal de enfermedad celíaca más completo conseguido hasta la fecha y va a permitir estudiar más a fondo y con mayor fiabilidad los mecanismos patogénicos de la enfermedad celíaca.
En este apartado de inmunopatogenia se mostraron también otros avances. El Dr. Frits Koning (Centro Médico Universitario de Leiden, Holanda) habló sobre la adquisición del citómetro de masas, una máquina que permite caracterizar una variedad ingente de tipos celulares presentes en una muestra, por ejemplo, una biopsia de duodeno. Su tecnología permite analizar hasta 39 marcadores diferentes simultáneamente. Cada tipo celular tiene sus propios marcadores (proteínas presentes en su superficie), de forma que se pueden detectar, separar y estudiar células que difieren de las demás en su combinación de marcadores superficiales. Es una herramienta de tremenda utilidad en patologías de base inmunológica, pues permiten averiguar qué células están actuando en cada momento y en cada lugar, según la muestra que se utilice y la fase de la enfermedad.
Y el Dr. Hugh Reid (Australia) ha descrito cómo es la unión específica de ciertos péptidos del gluten con las proteínas HLA-DQ2 de bajo riesgo, que ahora ya van siendo tenidas en cuenta cuando se hace el estudio de predisposición a enfermedad celíaca. Esta unión es necesaria para que sujetos con estas variantes de bajo riesgo sean capaces de poner en marcha la maquinaria inmunológica que da lugar a la enfermedad celíaca.
Enfermedad celíaca refractaria
La enfermedad celíaca refractaria se define como la persistencia o reaparición de síntomas de malabsorción y atrofia de vellosidades después de 6 meses (o mejor un año) haciendo una dieta estricta sin gluten, tal como definió el Dr. Joseph Murray, gastroenterólogo de la Clínica Mayo de Rochester, en Minnesota (Estados Unidos). Los síntomas característicos son diarrea persistente y múltiples carencias nutricionales. Se trata de una complicación de la enfermedad celíaca que afecta a menos del 2% de los pacientes y se da casi exclusivamente en adultos; en niños es muy rara.

Antes de diagnosticar enfermedad celíaca refractaria es necesario asegurar:
- Que el paciente hace correctamente la dieta sin gluten.
- Que el diagnóstico de la enfermedad celíaca se hizo correctamente.
- Que no existen otras causas de enteropatía diferentes de la enfermedad celíaca, como la enteropatía autoinmune, el sprue tropical o una hipogammaglobulinemia primaria
- Que no existen otras causas de persistencia del daño intestinal, como la insuficiencia pancreática exocrina, la colitis microscópica o el sobrecrecimiento bacteriano.
Si ninguno de los puntos anteriores explica la persistencia de síntomas y de atrofia, lo más probable es que se trate de enfermedad celíaca refractaria (ECR), de la que existen dos tipos con diferente pronóstico. El porcentaje de supervivencia de los pacientes a los 5 años del diagnóstico es del 80% para la ECR tipo 1 y del 45% para la ECR tipo 2. El tratamiento recomendado combina la suplementación nutricional con la administración de inmunosupresores.
La terapia nutricional depende del grado de malabsorción. Si es leve, la suplementación con vitaminas (B9, B12, D) y minerales (hierro, calcio, cobre, zinc) es suficiente. Si es más seria y se presenta con hipoproteinemia, requiere alimentación elemental por vía entérica.
La terapia inmunosupresora puede consistir en la administración de corticoides o bien de esteroides de uso tópico. Los primeros tienen efectos adversos a largo plazo y entre los segundos, el más utilizado es la budesonida, muy eficaz para mejorar los síntomas, pero no tanto para lograr la recuperación de la lesión intestinal. En su lugar también se emplea el Entocor, indicado en enfermedad de Chron, pero también eficaz en este caso.
Precisamente sobre la eficacia de la budesonida presentó datos la Dra. Sherine Khater (Francia). Según sus resultados, se logra la remisión de los síntomas en el 94% de los casos. La recuperación intestinal, sin embargo, sólo es completa en el 22% de los pacientes, y parcial en el 27%. No detectó ningún efecto en el porcentaje de linfocitos T intraepiteliales aberrantes.
También se contempla como posible tratamiento el transplante de médula ósea, autólogo en etapas iniciales de la enfermedad o heterólogo si está más avanzada, según la Dra. Nadine Cerf-Bensussan (Universidad Descartes-Sorbona de París, Francia), quién habló también de los últimos hallazgos relacionados con las células intraepiteliales, que tienen un papel clave en la enfermedad celíaca refractaria.
Estas células poseen los marcadores típicos de los linfocitos T intraepiteliales, las proteínas CD103 y CD3, pero ésta última no se encuentra en la superficie de la célula, sino en su interior, lo que convierte a estas células en linfocitos T aberrantes evolucionan hacia un linfoma T intraepitelial en el 50% de los casos, haciendo de la enfermedad celíaca refractaria un buen modelo para estudiar este tipo de linfomas.

Los linfocitos T aberrantes poseen ciertos rasgos que son más propios de las células NK (Natural Killer), cuya actividad citotóxica destruye las células del epitelio intestinal en presencia de IL15 sin necesidad de un estímulo antigénico específico, por lo que su actividad es ya independiente del gluten. De hecho, se ha demostrado que migran directamente desde la médula ósea, donde se encuentran las células madre hematopoyéticas, hacia el intestino sin pasar por el timo, donde habitualmente los linfocitos T siguen su proceso de selección y maduración.
También las últimas investigaciones han demostrado fallos genéticos que impiden la correcta diferenciación de los linfocitos T inmaduros hacia linfocitos T citotóxicos funcionales, dando lugar a los linfocitos T aberrantes. Estas alteraciones genéticas se están estudiando ahora para poder utilizarlas en un futuro como marcador genético de enfermedad celíaca refractaria.
Nuevas terapias
El Dr. Chaitan Khosla (Universidad de Stanford, California, Estados Unidos) comenzó este último bloque hablando de las transglutaminasas (TG) como diana terapéutica en enfermedad celíaca. Se trata de una familia de 9 proteínas con actividad enzimática (TG1, TG2, …, TG9) que están presentes en todos los tejidos y se pueden encontrar tanto dentro como fuera de las células. En los trastornos relacionados con el gluten tienen relevancia la transglutaminasa intestinal (TG2), la transglutaminasa epidérmica (TG3) y la transglutaminasa neuronal (TG6), contra las que se generan anticuerpos en la enfermedad celíaca, la dermatitis herpetiforme y la ataxia por gluten, respectivamente. En condiciones normales se encuentran inactivas, pero se activan rápidamente en procesos inflamatorios. La TG2 es clave para la modificación química del gluten que convierte las gliadinas en gliadinas desamidadas, que son altamente “tóxicas” para los celíacos. Experimentos realizados con ratones prueban que el bloqueo de las transglutaminasas no tiene ningún efecto negativo para el organismo y por ello se sugiere su bloqueo como terapia, aunque es una estrategia discutida por otros investigadores.
Más prometedoras parecen las terapias de inmunomodulación, que persiguen reeducar al sistema inmunológico para que no responda de manera adversa frente al gluten. El Dr. Bob Anderson director científico de la compañía ImmusanT Ltd. (Cambridge, Massachussets, Estados Unidos), presentó algunos resultados tras concluir 4 ensayos clínicos que se han realizado en fase 1 con la vacuna experimental NexVax2 en pacientes. En ellos se ha administrado una dosis fija de 150 microgramos de la vacuna durante 8 semanas mediante inyección intradérmica. Si bien no hay evidencias de activación inmunológica inducida por los péptidos de gluten que contiene, se han observado efectos adversos como náuseas, vómitos, dolor abdominal y diarreas, sobre todo tras la primera dosis y al cabo de 2 horas de su administración.
La vacuna está compuesta por 3 péptidos de gluten que contienen una secuencia de 9 aminoácidos que han demostrado ser los que mayor capacidad tienen para activar linfocitos T extraídos de sujetos celíacos con la variante proteica DQ2. Fueron seleccionadas de entre un total de 7.561 péptidos de gluten que activan linfocitos T en algún paciente. Los 3 elegidos fueron capaces de activar a los linfocitos T de 2 de cada 3 pacientes y por tanto eran potencialmente aptos para ser incluidos en una vacuna que pueda ser efectiva en la mayoría de sujetos celíacos DQ2. La activación de linfocitos T exige un reconocimiento específico de los péptidos que es imprescindible para que la vacuna sea efectiva.
Los siguientes pasos requieren ensayar dosis más altas y la estrategia es administrar inicialmente dosis muy bajas, por debajo de los 150 microgramos para prevenir la reacción adversa, que después se vayan incrementando hasta los 900 microgramos a lo largo de las semanas de intervención.
Por otro lado, el Dr. Jack Syage (Estados Unidos) habló de la latiglutenasa, un fármaco experimental para enfermedad celíaca bautizado inicialmente como ALV003 y consistente en dos proteasas recombinantes que degradan gluten. Los últimos resultados publicados de los ensayos clínicos llevados a cabo con pacientes no mostraron ningún efecto de este fármaco en cuanto a mejoría en los síntomas o reparación de la lesión intestinal. Sin embargo, el último ensayo clínico realizado por la compañía estadounidense ImmunogenX, el ensayo ALV003 CeliAction (ALV003-1221), aunque tampoco ha podido demostrar efectos beneficiosos a nivel intestinal, sí ha probado la mejora sintomática, pero sólo en los pacientes que tenían anticuerpos positivos, el 43% del total de sujetos seleccionados para el ensayo, resultado inesperado que ha sorprendido a los investigadores. Los síntomas que remitieron de manera más notable fueron el dolor y la distensión abdominal, cuya frecuencia y severidad se redujeron. También mejoró el estreñimiento y la fatiga. La mejoría observada es dependiente de la dosis de fármaco administrada.
Finalmente, el Dr. Francisco León (Estados Unidos), tras hacer un repaso rápido a las diferentes estrategias terapéuticas que se encuentran en diversas fases de ensayo preclínico o clínico, presentó el fármaco experimental AMG714 que está ensayando la compañía que dirige, Celimmune Ltd., destinado a pacientes de enfermedad celíaca refractaria. Este fármaco, que bloquea la acción de la interleuquina 15, ha demostrado su capacidad para aliviar los síntomas intestinales asociados al consumo de gluten, como la diarrea y la pérdida de peso, además de su seguridad, pues no se han observado efectos secundarios asociados. Los primeros ensayos realizados con pacientes de enfermedad celíaca refractaria han probado su eficacia al reducir la inflamación y los síntomas, y también la expansión clonal de los linfocitos T aberrantes, responsables del linfoma al que dan lugar en buena parte de estos pacientes.
El Dr. León estima que en 2020 habrá probablemente uno o dos fármacos ya en el mercado para la enfermedad celíaca.
Autor: Juan Ignacio Serrano Vela. Doctor en Biología.