NOTICIAS
Resumen: 38ª Reunión del Grupo de Trabajo WGPAT

El Grupo de Trabajo sobre Análisis y Toxicidad de las Prolaminas (WGPAT) celebró en la ciudad italiana de Ancona su 38ª reunión anual, en la que se pusieron en común los últimos avances clínicos y analíticos relacionados con la enfermedad celíaca y con la detección de gluten en alimentos. Se aprovechó la ocasión para hacer un repaso histórico de este grupo de trabajo que ha cumplido 40 años de historia en 2025.
Historia del WGPAT
La conferencia inaugural corrió a cargo del Dr. Martin Stern, pediatra gastroenterólogo alemán que presidió este grupo de trabajo durante 20 años, entre 1991 y 2011, al que se había unido pocos años después de su fundación. El grupo había sido creado en 1985 por el Prof. Wim Hekkens, de la Universidad de Leiden (Países Bajos) y en aquellos inicios contaba con 8 miembros, uno de ellos, el Dr. Paul Ciclitira, reputado gastroenterólogo del hospital londinense de St. Thomas, es el único de los fundadores que sigue acudiendo a estas reuniones con sus cerca de 80 años.

El grupo tuvo desde su origen una doble vertiente, clínica y analítica, siendo sus principales objetivos el desarrollo y mejora de los métodos analíticos de gluten en alimentos y la evaluación de la sensibilidad de los pacientes frente al gluten. Destaca por su carácter multidisciplinar, con científicos expertos en física, bioquímica, nutrición o ciencia y tecnología de alimentos, así como con fabricantes de métodos analíticos destinados tanto al diagnóstico como a la seguridad alimentaria, representantes de la industria alimentaria, expertos en temas legales y asociaciones de pacientes.
Como hitos destacables figuran el desarrollo y validación del primer test ELISA para la detección de gluten en alimentos, basado en el anticuerpo de Skerrit, entre 1986 y 1992, o los estudios de tolerancia de productos con avena y almidón de trigo entre 1994 y 1998. En 1996 ya estaba en marcha un nuevo test ELISA, en este caso basado en el anticuerpo R5, desarrollado por el español Enrique Méndez, investigador del Centro Nacional de Biotecnología del CSIC, en Madrid, otro exponente destacado del grupo, que falleció prematuramente. Tras su validación en 2003, es el método actual de referencia para el análisis de gluten en alimentos y el único reconocido por la legislación vigente para este fin.
En 1999, el grupo adquirió estatus de observador como organización no gubernamental en el Codex Alimentarius, estamento vinculado a la Organización para la Agricultura y la Alimentación (FAO) de las Naciones Unidas y a la Organización Mundial de la Salud (OMS) dedicado a elaborar estándares de calidad, seguridad y buenas prácticas en la producción y el comercio internacional de alimentos para proteger la salud de los consumidores. Sus normas, o estándares, sirven de base para los avances legislativos en materia de seguridad alimentaria. Cuenta con 189 miembros (188 estados más la Unión Europea) y 243 observadores. En 2008, el Codex adoptó la norma para alimentos destinados a personas con intolerancia al gluten, que fijaba en 20 miligramos de gluten por kilo de alimento (20 partes por millón, ppm) el límite máximo de gluten permitido en estos alimentos en base a los estudios de sensibilidad realizados con pacientes y a las metodologías de análisis de gluten en alimentos y que dio pie a la legislación que hoy se aplica en la Unión Europea, Estados Unidos o Canadá.
Destacado fue también el papel del WGPAT en el desarrollo de un material de referencia, denominado PWG-Gliadin, con un contenido y conocido y representativo de gluten, que sirviera para calibrar y validar de la manera más fiable posible los diferentes métodos analíticos en desarrollo. Se obtuvo en 2000 y aún se dispone de stock suficiente para que los laboratorios puedan seguir empleándolo como referencia para la validación de sus métodos.
Patogénesis de la enfermedad celíaca
En 1988 se identificó el péptido tóxico de gluten p31-59, resultante de la digestión de esta proteína con quimiotripsina, que se asociaba con la reducción de la altura de los enterocitos. En 1994-1995 se identificó otro péptido tóxico, p31-49, asociado a la reducción de altura de los enterocitos y al aumento de linfocitos intraepiteliales. En 1996 se identificó el péptido tóxico p31-43, asociado a la reducción de altura de los enterocitos y al aumento de linfocitos intraepiteliales. En este caso procede de la digestión completa del gluten con las enzimas gástricas, pancreáticas y duodenales. Es el péptido tóxico más común tras la digestión del gluten y provoca un daño muy específico, con una inducción rápida de la muerte de las células intestinales pese a no tener, o no haberse encontrado aún, un receptor que determine su acción tan específica, no ejercida por otros péptidos de gluten. Lo investiga el Dr. Fernando Chirdo (Universidad Nacional de La Plata, Argentina), en busca del mecanismo que explica la toxicidad del gluten en las etapas más iniciales de la enfermedad.

Enfermedades inflamatorias inducidas por el trigo
Se estima que el consumo de trigo genera problemas de salud de naturaleza inflamatoria en aproximadamente el 15% de la población europea y norteamericana. Se trata, tal como expuso el Dr. Detlef Schuppan (Universidad de Mainz, Alemania), de la EC (1%-2%), inducida por gluten y de tipo autoinmune, la alergia al trigo tipo 1 (inmediata, mediada por IgE) (0,2%), inducida por el gluten u otras proteínas del cereal, la alergia al trigo tipo 2 (retardada, de tipo citotóxica, mediada por IgG e IgM) (5%), inducida por proteínas de este cereal diferentes del gluten, y la sensibilidad a ATI (10%), inducida por inhibidores de amilasa-tripsina, unas proteínas diferentes del gluten presentes en el grano de trigo.
Los ATI son objeto de investigación por su papel en la inducción o potenciación de procesos inflamatorios en el intestino y en otros órganos. Representan el 1,5% del contenido proteico total en el grano de trigo. En una dieta estándar con gluten basada en el trigo, este cereal representa el 30% de la ingesta diaria, lo que supone la ingesta de 1 gramo de ATI al día. Se postula que una dieta sin gluten que implique una reducción en torno al 95% en la ingesta de ATI puede ayudar en el tratamiento de enfermedades inflamatorias y metabólicas como la colitis, enfermedades hepáticas por acumulación de grasa (NASH, MASLD), enfermedades autoinmunes del sistema nervioso central, esclerosis múltiple o lupus eritematoso sistémico. Según el Dr. Schuppan, se puede ensayar la dieta sin gluten baja en ATI en estos casos durante 4 semanas y mantenerla si se observa mejoría.
La dieta sin gluten se recomienda también a personas sin EC en las que se sospecha una posible sensibilidad al gluten no celíaca (SGNC). Este grupo de pacientes es muy heterogéneo y el gluten solo explica el problema en una minoría de los casos. Los mencionados ATI y los fructanos, unos hidratos de carbono del grupo de los FODMAP (acrónimo en inglés que alude a unos carbohidratos fermentables que incluyen monosacáridos, disacáridos, oligosacáridos y polioles fermentables no absorbibles), se investigan como componentes del trigo diferentes del gluten que puedan causar esta sensibilidad (frecuentemente aludida como intolerancia) al gluten (o al trigo) no celíaca.
La Dra. Stefania Masci (Universidad de la Tuscia, Viterbo, Italia) ha estudiado el contenido en ATI y fructanos en diferentes variedades de trigo antiguas y modernas cultivadas en Sicilia para conocer su posible implicación en el aparente auge de los problemas de salud vinculados con el consumo de trigo. El contenido en fructanos en las harinas de estos trigos está en torno al 2%, similar a la avena, y no ha encontrado diferencias relevantes en el contenido en ATI entre los diferentes trigos estudiados. De hecho, las variaciones en el contenido en ATI y fructanos está más ligada a la variedad de trigo y al entorno ambiental en el que se cultiva que a su antigüedad. Sí ha podido demostrar, en cualquier caso, que el trigo diploide ancestral conocido como emmer es 5 veces menos alergénico que el trigo actual hexaploide, conocido como trigo harinero. Los ATI tienen demostrada su capacidad para inducir procesos inflamatorios en el intestino y los fructanos se vinculan con los síntomas de intestino irritable.

Cribado masivo de la enfermedad celíaca, ¿ha llegado el momento?
Los estudios epidemiológicos realizados en diferentes países y grupos de población dejan patente el grado de infradiagnóstico de la EC, con un porcentaje de pacientes que no llegan a ser detectados ni por los síntomas que puedan presentar ni por su pertenencia a grupos de riesgo, ya sea por tener algún familiar cercano con EC o por padecer alguna otra enfermedad autoinmune. Lo expuso la Dra. Iris Jonkers (Universidad de Groningen, Países Bajos), quien ofreció datos de algunos de ellos. En edad pediátrica, la prevalencia de EC (en base al resultado positivo de anticuerpos antitransglutaminasa en sangre) oscila entre el 1,4% y el 2,6% y en edad adulta ronda el 1,5%, con un alto porcentaje de casos no diagnosticados, entre el 50% y el 75%, detectados gracias a estos cribados poblacionales.
Estos datos apoyan los cribados masivos para sacar a la luz los casos ocultos, pero hay otros aspectos a considerar, como son la historia natural de la patología (cuál es el curso de la enfermedad a lo largo del tiempo en los casos no detectados) o el impacto emocional y el grado de adherencia al tratamiento en los casos asintomáticos no pertenecientes a grupos de riesgo que no habrían sido detectados de otra forma por no tener síntomas, ni familiares afectados ni patologías asociadas. El aspecto económico y logístico (qué pruebas realizar, en qué momento y con qué frecuencia) también es relevante, y de ello habló el Dr. Edwin Liu (Hospital Infantil de Colorado Springs, Estados Unidos).
Los grandes estudios epidemiológicos ayudan a aclarar algunas de estas cuestiones. Los estudios DAYSY (1993-2004) y TEDDY (2004-2010), ideados para la diabetes tipo 1 pero útiles también para la EC por la base genética común y las similitudes entre ambas, han demostrado que la mayoría de los casos de EC en edad pediátrica surgen muy pronto, antes de los 5 años, también los marcadores serológicos de autoinmunidad (antitransglutaminasa en el caso de la EC, otros en el caso de la diabetes tipo 1).
El estudio ASK (Autoimmunity Screening for Kids), iniciado en 2017 con el objetivo de cribar la EC y la diabetes tipo 1 en 50.000 menores en el estado de Colorado, también está ofreciendo datos muy relevantes. El diseño no contempla realizar primero el estudio genético HLA para después analizar anticuerpos en sangre en los casos con genética positiva dado el elevado coste de la prueba genética, que equivale a 5 análisis de anticuerpos, por lo que se está realizando el estudio serológico de anticuerpos a todos los casos que se van reclutando. Los que muestran valores bajos de anticuerpos en sangre (menos del doble del valor normal) son emplazados a una segunda analítica en 6 meses si no presentan síntomas. Si presentan síntomas o tienen valores de anticuerpos por encima del doble del valor normal, la segunda analítica se realiza poco después de la primera.
En los primeros 10.000 participantes, se han detectado valores positivos de anticuerpos antitransglutaminasa (anti-TG2) en el 2,4% de los casos, permaneciendo positivos el 80% de ellos en la segunda analítica, lo que sitúa la seroprevalencia de EC en el 1,9%. De ellos, el 3,8% tiene algún familiar con EC y el 5% tiene algún familiar con diabetes tipo 1. Un 10% de los casos positivos no tiene ningún familiar afectado por EC o diabetes tipo 1. Además, se ha comprobado que la presencia de síntomas no discrimina entre los positivos y los negativos, en torno al 30% de los menores evaluados presentaban síntomas, tanto los que mostraban anticuerpos como los que no.
El Dr. Liu fue el anfitrión en 2024 del primer simposio internacional que se celebra sobre cribado masivo de la EC, lo que muestra la relevancia que está adquiriendo esta estrategia como opción para lograr un diagnóstico precoz de la patología y sobre todo para diagnosticar los casos que no serían detectados de otra manera. El principal problema es que las personas asintomáticas detectadas por cribado tienen dificultad para aceptar la EC y existe el riesgo de que no sigan el tratamiento. Los datos preliminares del estudio ASK muestran que solo el 57% de los casos que resultan positivos en la primera analítica acude a la segunda analítica para ratificar el positivo, y de éstos hasta un 57,8% no acude después a la consulta de gastroenterología para finalizar el diagnóstico. Con todo, se estima que un 40% de los casos inicialmente positivos se perderían por el camino.
En Estados Unidos se considera que el cribado masivo de la EC es viable en el ámbito de la investigación, pero no está tan claro que su implementación en el sistema sanitario del país sea abordable, ni se ha estimado si el coste real es asumible por el sistema público de salud y por los proveedores privados de atención sanitaria teniendo en cuenta el coste de las pruebas y el coste de tiempo y personal necesarios para llevarlos a cabo, sin olvidar el impacto que puede tener el incremento en el número de diagnósticos a la hora de atender sus necesidades.
En la Unión Europea el sistema sanitario es algo diferente y es precisamente un país europeo, Italia, el primero en el mundo en aprobar una ley y un presupuesto para el cribado masivo de la EC (y la diabetes tipo 1) en la población infantil. La Ley 130/2023 fue aprobada a finales de 2023 por amplia mayoría, tras un tiempo récord de tramitación parlamentaria de tan solo 6 meses. Lo relató el Dr. Carlo Catassi (Universidad Politécnica de las Marcas, Ancona, Italia), experto consultado para la formulación de esta ley. En 2024 se inició el cribado con una prueba piloto en 4 regiones italianas y un total de 5.363 menores para evaluar la viabilidad del programa. A diferencia del estudio ASK de Colorado, el diseño italiano incluye como primera prueba el estudio genético HLA, para continuar después con el análisis serológico de anticuerpos en los casos con genética positiva. La prueba genética tiene un coste asumible si se buscan solo los principales alelos de riesgo (DQB1*02 y DQB1*03:02). Esto dejaría fuera un 3% de casos con variantes de riesgo menos comunes, una desventaja que se considera asumible.
Está planteado realizar el cribado a los 2, a los 6 y a los 10 años de edad, con lo que se espera detectar a la práctica totalidad de los casos de EC con la citada genética de riesgo. Los datos obtenidos hasta la fecha, presentados por la Dra. Olimpia Vincentini (Universidad de Bolonia, Italia) muestran que el 44% de los menores seleccionados para el cribado presentaban la genética de riesgo y fueron sometidos al análisis serológico de anticuerpos. Se comprobó que en torno al 2,8%-2,9% de los menores que han participado en el cribado tenían valores positivos de anticuerpos de EC en sangre, el doble de lo esperado, y el 0,8% tenían anticuerpos específicos de diabetes tipo 1.
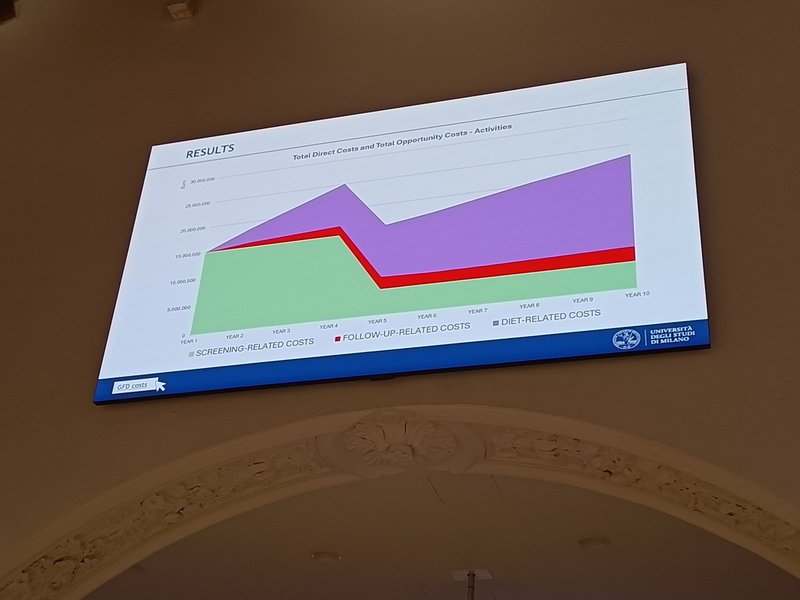
La investigadora Letizia Magnani (Universidad de Milán, Italia) mostró por último una simulación del impacto económico de un programa de cribado masivo aplicado a una región como Lombardía con una población de 10 millones de habitantes. La estimación del gasto debe incluir los costes directos (material, personal, infraestructura, etc.) y los costes de oportunidad (tiempo dedicado al programa de cribado que no se emplea en otras tareas), tanto del sistema público de salud como de los proveedores de servicios sanitarios. Como puntos críticos en un programa de este tipo figuran la falta de datos sobre el ahorro que puede suponer la detección precoz de la enfermedad como el gasto adicional que recaería sobre el sistema por el efecto cascada derivado de cada diagnóstico (cribado familiar), sin contar el efecto psicológico y sus consecuencias en los casos asintomáticos detectados en el cribado. Con todo, el coste inicial, al comenzar el cribado, ascendería a 15 millones de euros y se elevaría hasta los 25 millones en 4 años al sumar los costes de seguimiento y las ayudas económicas a pacientes existentes en Italia. Después se reducirían al descender el número de personas pendientes de cribado y volverían a ascender paulatinamente año tras año a medida que se fueran acumulando nuevos pacientes diagnosticados hasta alcanzar una línea de gasto más estable a partir de los 10 años ligada ya principalmente al soporte económico para la compra de alimentos sin gluten.
Nuevas herramientas de diagnóstico y seguimiento
Evolución de los métodos serológicos
En la década de 1960 se descubrió que las personas con EC generan anticuerpos contra el gluten (son los anticuerpos antigliadina y los posteriormente descubiertos antipéptidos desamidados de gliadina) y en la década de 1980 se descubrió que también generan anticuerpos antiendomisio, que realmente son anticuerpos dirigidos específicamente contra la enzima transglutaminasa tisular (TG2), identificada como el autoantígeno de la EC en 1997. Estos anticuerpos circulan por la sangre, lo que dio pie al desarrollo de métodos analíticos como prueba inicial en el proceso de diagnóstico de la EC.
Todos los métodos se basan en la misma propiedad: la unión específica entre los anticuerpos y su diana, de manera que los métodos de detección de anticuerpos “anti-gluten” utilizan placas con fragmentos de gluten inmovilizados sobre las que se deposita la muestra sanguínea. En caso de haber anticuerpos en sangre, quedarán unidos al gluten en las placas. Lo mismo si se desea detectar la presencia de anticuerpos antitransglutaminasa, en cuyo caso las placas contendrán esta enzima inmovilizada en su superficie.
La eficacia de estos métodos depende básicamente de dos factores. El primero es la especificad de la unión del anticuerpo al sustrato fijado a las placas (denominado antígeno, que es su diana específica). Los fabricantes de tests serológicos de anticuerpos deben asegurarse de que el antígeno empleado como diana solo sea reconocido por el anticuerpo deseado, ya que en sangre pueden estar circulando diferentes anticuerpos contra diferentes antígenos y ninguno que no sea el deseado debería unirse a la placa, ello daría lugar a un falso positivo. Pero también tienen que asegurar que la afinidad del anticuerpo por su antígeno sea suficiente para que la unión se produzca, ya que si no es así se obtendría un resultado falso negativo.
El segundo factor es crucial y tiene que ver con la detección (y cuantificación) de los anticuerpos unidos. Para ello se han desarrollado a lo largo de los años diferentes estrategias físicas, químicas y biológicas encaminadas a que se produzca algún tipo de señal detectable cada vez que un anticuerpo queda unido a su antígeno en la placa, y es lo que repasó la Dra. Damiana Pieragostino (Universidad Gabriele D’Annunzio, Pescara, Italia). De ahí surgen el Radioinmunoensayo (RIA, la señal es radiactiva), el tan extendido Enzimoinmunoensayo (ELISA, la señal surge de una reacción enzimática), los inmunoensayos de quimioluminiscencia (CLIA, emite luz) y fluorescencia (FEIA, emite una señal fluorescente) o los innovadores inmunoensayos ADAP (el anticuerpo es detectado mediante una sonda amplificable de ADN) y DELFIA (una versión mucho más potente de los que emiten fluorescencia). El objetivo en la evolución de estos métodos es lograr detectar una señal ante concentraciones cada vez más bajas de anticuerpos en sangre para mejorar su potencial diagnóstico.
La biopsia líquida: tecnología Olink®
El avance de la tecnología permite disponer de nuevas herramientas para detectar biomarcadores que identifiquen de forma fiable condiciones patológicas. En el caso de la EC, la tecnología Olink® permite rastrear decenas de biomarcadores en muestras líquidas, como sangre, orina, saliva o líquido cefalorraquídeo. Esta nueva herramienta para el diagnóstico se ha dado en llamar biopsia líquida y fue presentada por el Dr. Knut Lundin (Universidad de Oslo, Noruega). Destaca por su mayor sensibilidad frente a los métodos convencionales de bioquímica clínica o los inmunológicos ELISA y Western Blot, y destaca también por su selectividad frente a métodos como la espectrometría de masas. En una persona que hace dieta sin gluten, se puede así detectar interleuquina 2 (IL-2) en sangre a las 4 horas de una ingesta puntual de gluten, lo que permite confirmar, por ejemplo, que se trata de EC y no de una posible sensibilidad al gluten no celíaca (SGNC). Y un estudio que ha analizado con esta técnica 96 biomarcadores de inflamación en personas con EC recién diagnosticadas, en personas con EC que ya llevan un tiempo a dieta sin gluten y en personas sanas que hacen dieta normal con gluten ha identificado 3 de estos biomarcadores (CXCL11, CXCL6 e IL-17A) que se correlacionan con el grado de lesión intestinal, especialmente el primero.
Esta tecnología puede aplicarse también a desentrañar casos dudosos, como la EC no respondedora, a la que dedicó su intervención el Dr. Detlef Schuppan (Universidad de Mainz, Alemania). Un metaanálisis de 5 estudios con pacientes de EC que no mejoraban a pesar de la dieta sin gluten ha determinado que esta situación se da en el 22% de los pacientes y concluye que entre las causas de no respuesta destacan la mala adherencia a la dieta sin gluten (33%), la EC refractaria (12%) y la colitis microscópica (6%). Otras causas pueden ser el síndrome de intestino irritable o las alergias alimentarias tipo 2.
Igualmente es útil en el estudio de la EC potencial, caracterizada por la elevación de anticuerpos específicos en sangre con una mucosa intestinal sin lesiones (Marsh 0) o con leve inflamación sin atrofia (Marsh 1). Según expuso la Dra. Renata Auricchio (Universidad Federico II de Nápoles, Italia), se presenta con síntomas en el 4%-73% de casos en la edad pediátrica y en el 49%-92% en la edad adulta. Se caracteriza por una inflamación de bajo grado en la lámina propia, con una disminución de células CD25+, células FoxP3 y depósitos de IgA. Si mantienen una dieta normal con gluten, el 30%-40% de los casos permanecen en estado potencial a lo largo del tiempo, el 30%-40% desarrollan una EC activa con atrofia de vellosidades (lesión Marsh 3) y el 20%-30% revierten de forma espontánea. La tecnología Olink® en este caso persigue identificar marcadores que ayuden a predecir qué casos de EC potencial evolucionarán hacia EC activa si mantienen el gluten en su dieta.
Seguimiento mediante microARN
El control de la buena adherencia a la dieta sin gluten también es un reto y se buscan biomarcadores que diferencien bien entre personas con EC que aún no han iniciado la dieta sin gluten, personas con EC que ya están a dieta sin gluten y personas sanas. Entre los posibles marcadores se encuentran los denominados microARN, pequeñas moléculas de material genético cuya función es regular la expresión de genes, relacionados con los procesos inflamatorios en el caso de la EC. Los estudios del Dr. Andrea Massoti (Universidad La Sapienza de Roma, Italia) ha identificado 3 microARN que se expresan de manera diferente en los 3 grupos de pacientes estudiados (400 sujetos por grupo) y que pueden ser detectados tanto en sangre como en saliva.

La dieta sin gluten
¿Cuál es el límite de gluten seguro?
El límite de 20 miligramos (mg) de gluten por kilo (Kg) de alimento (20 partes por millón, ppm) que no deben superar los alimentos sin gluten comercializados en la Unión Europa, Estados Unidos o Canadá deriva del estudio realizado por el Dr. Carlo Catassi (Universidad Politécnica de Las Marcas, Ancona, Italia) en su país en 2007. Evaluó el efecto del consumo diario de 0 mg, 10 mg y 50 mg de gluten durante 3 meses en pacientes con EC, concluyendo que la dosis de 50 mg de gluten al día era capaz de causar daño intestinal en todos los participantes. Sin embargo, se obtuvieron resultados contradictorios en los grupos de pacientes que ingirieron 0 mg y 10 mg. Algunos de los participantes del grupo placebo (0 mg) mejoraron, lo que indica que su dieta sin gluten no era suficientemente estricta antes del ensayo, mientras que en el grupo que ingirió 10 mg en unos casos se observó un empeoramiento mientras que otros permanecieron igual que al principio, considerando esta dosis una zona oscura que requiere mayor investigación.
Se sabe que un porcentaje relevante de pacientes con EC no logra la plena reparación de su lesión intestinal, lo que lleva a pensar que el límite de las 20 ppm tal vez no es seguro para todos los pacientes. Sin embargo, la mayoría de los productos sin gluten comercializados, a pesar de admitir hasta 20 mg/kg de gluten, contienen cantidades de gluten indetectables, por lo que tal vez la ausencia de mejoría tenga otras causas. De hecho, hasta la fecha no se han reportado complicaciones de la EC vinculadas al consumo de productos sin gluten limitados a 20 ppm, y por ahora no se ha estudiado si la recuperación intestinal de las personas con EC es mejor en países con límites legales de gluten más restrictivos, como Argentina (10 ppm) o Australia (5 ppm). Es posible, por tanto, que la falta de mejoría sea atribuible a ingestas voluntarias o inadvertidas de gluten, o a contaminación durante la elaboración de ciertos alimentos sin gluten, más que al gluten residual que puedan contener los productos comercializados sin gluten (hasta 20 mg/kg en nuestro caso).
A diferencia de lo que ocurre en las alergias alimentarias, en las que una pequeña y única dosis del alérgeno puede desencadenar la reacción si se supera el umbral, en el caso de la EC la toxicidad del gluten tiene más un efecto acumulativo cuando se trata de pequeñas dosis ingeridas de forma habitual. La disponibilidad actual de métodos muy sensibles para detectar en sangre biomarcadores de activación inmunológica en respuesta a la ingesta de gluten, como la interleuquina 2 (IL-2, se eleva a las 4 horas de la ingesta), posibilitan hoy estudiar el impacto inmunológico de la ingesta de pequeñas dosis de gluten (por debajo de los 10 mg) y su potencial lesivo a largo plazo si, por ejemplo, se ensaya un consumo diario durante periodos de entre 4 y 12 semanas.
Futuros fármacos
El Dr. Knut Lundin (Universidad de Oslo, Noruega) hizo un rápido repaso de algunos de los fármacos experimentales que se ensayan para tratar la EC y se centró en las vacunas. Si bien algunos fracasaron, como los ensayos con la vacuna NexVax2, proporcionaron mucho y muy valioso conocimiento sobre el funcionamiento de la EC. La rápida activación de células T específicas de gluten tras la inyección subcutánea o intradérmica de microdosis de gluten es tal vez uno de los hallazgos más relevantes en años, observado durante los ensayos de la vacuna. Una nueva generación de vacunas, basadas en la administración intravenosa de gluten incorporado en nanopartículas dirigidas hacia órganos linfoides como el hígado y el bazo para inducir tolerancia a esta proteína se están ensayando en este momento.

Aspectos legales
La presidenta de la Asociación de Celíacos de Austria, Hertha Deutsch, representante de la Asociación de Celíacos de Europa (AOECS) en las reuniones del Codex Alimentarius, resumió los principales avances normativos sobre el gluten. Tienen que ver con la diferenciación de la EC del concepto dicotómico de alergia o intolerancia clásicamente empleados para referirse a las reacciones adversas a alimentos, ya que la EC no es ni una cosa ni la otra y genera confusión a la hora de redactar y aplicar normativas. Se plantea, por tanto, excluir la EC de la definición de ‘alergia alimentaria’ en los textos del Codex y sustituir la alusión de ‘alergia alimentaria no mediada por IgE’ por ‘reacción adversa de hipersensibilidad inmunomediada’ al referirse a ella. Igualmente se ha solicitado la inclusión de la espelta entre las especies del género Triticum.
En la misma línea, se ha solicitado modificar la definición de ‘alérgeno alimentario’ para que sea aplicable también al gluten en los casos en los que provoca EC, de forma que quedaría definido como ‘sustancia capaz de desencadenar reacciones adversas mediadas por IgE -las clásicas alergias alimentarias- e inmunomediadas -la EC-‘. Esto es relevante también a la hora de regular la declaración de las trazas, pues su impacto en la salud es diferente según se trate de pacientes con alergia alimentaria o con EC. Existen en el mercado productos etiquetados sin gluten por contener menos de 20 ppm de gluten, que son aptos para celíacos, que a la vez declaran contener trazas de gluten, información relevante para alérgicos al gluten (son pocos, pero los hay), que pueden tener una reacción adversa si los consumen, lo cual genera confusión para los consumidores celíacos ante la ambigüedad o aparente contradicción de la información proporcionada.
En la última Asamblea Anual de la AOECS, celebrada el 17 de octubre de 2025, se acordó proponer al Codex la no declaración de trazas de trigo en los productos sin gluten (los que contienen menos de 20 mg/kg de gluten), de forma que se cumpla una regla del Codex que dice que sus normas no deben entrar en conflicto. Esto eliminaría la ambigüedad en los productos etiquetados sin gluten que declaran contener trazas de gluten, pero dejaría en el aire la seguridad para las personas alérgicas al trigo o al gluten. Está tabulado el umbral que no debe superar cada alérgeno, y en el caso del trigo está fijado en 5 mg. A partir de dicha cantidad debería declararse su presencia al entrañar un riesgo para la salud de las personas alérgicas. Hay que tener en cuenta que los umbrales en el caso de las alergias alimentarias son cantidades totales de alérgeno, independientemente de la cantidad de alimento ingerido. El umbral en el caso de la EC no es una cantidad total, sino una proporción referida a la cantidad de alimento: 20 partes por millón son 20 mg de gluten por cada kilo de alimento. Su efecto es acumulativo y a mayor cantidad de alimento mayor riesgo de sufrir alguna reacción adversa, de ahí la recomendación de no abusar de productos manufacturados, aunque sean sin gluten.
Se pretende en último término, y no solo en lo relativo al gluten, que los etiquetados sean lo más fieles posibles a la realidad. Por ahora el etiquetado precautorio (de declaración de alérgenos) no lo es. Un estudio realizado en 2022 analizó 128 productos sin gluten, 77 declaraban trazas de gluten y 51 no. Entre los 77 que declaraban trazas de gluten, 74 contenían menos de 20 ppm, pero 3 superaban ese límite y por tanto no eran ‘sin gluten’. Y entre los 51 que no declaraban trazas de gluten, 48 contenían menos de 20 ppm pero 3 superaban dicho límite. Tan importante es declarar las trazas cuando están presentes como evitar su declaración generalizada cuando no existe riesgo de contaminación, asunto en el que se está trabajando intensamente, especialmente con los fabricantes, desde diversos estamentos, como la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN) en el caso de nuestro país, en cuyas reuniones participa nuestra Asociación para trasladar a la Unión Europea éstas y otras demandas que aún requieren atención y soluciones desde la perspectiva de las personas afectadas por la EC.
Autor: Juan Ignacio Serrano Vela. Doctor en Biología. Servicio de Investigación de la Asociación.